
北京佑安医院联合南加州大学KECK医学院共同揭示 线粒体自噬调控肝癌干细胞新的分子机制
北京市肝癌研究所的刘凯博士(研究员)历经近三年半的实验和观察,完成对线粒体自噬调控肝癌干细胞(LCSCs)产生的研究,以第一作者撰写的论著 “Mitophagy Controls the Activities of Tumor Suppressor p53 to Regulate Hepatic Cancer Stem Cells”,近日被国际知名杂志《Molecular Cell》(IF:14.7) 接收。
该论著由美国南加州大学KECK医学院、首都医科大学附属北京佑安医院和北京市肝病研究所三家单位合作完成,通信作者是James Ou教授,他是美国南加州大学KECK医学院分子微生物学和免疫学系教授、北京市肝病研究所海聚人才、台湾中研院院士。Ou教授团队在HBV、HCV和自噬等研究领域都有着卓越成就。在2014和2015年间,Ou教授指导刘凯博士在其实验室完成该研究的大部分实验工作。2016年刘凯博士回国,在Ou教授和陈德喜教授的指导下继续完成该研究的剩余实验工作。
LCSCs是引起肝癌发生、发展和复发的关键因素之一。该研究发现当p53的392位丝氨酸磷酸化后,p-p53(S392)会直接与转录因子Nanog的启动子结合而抑制Nanog的转录。Nanog的表达对于正常干细胞、诱导多能干细胞和肿瘤干细胞的产生和功能发挥着重要作用,因此p-p53(S392)通过抑制Nanog的表达可明显抑制LCSCs的产生和功能。另外p-p53(S392)被发现可以定位在线粒体,并且当线粒体自噬功能正常时,线粒体自噬通过降解p-p53(S392)来调节p-p53(S392)的水平,从而间接地调节了LCSCs的产生和功能。
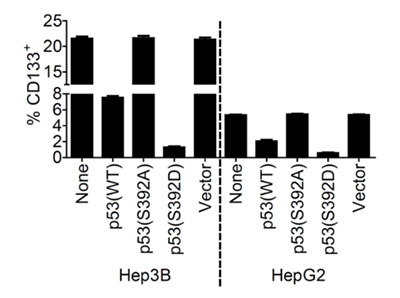
图1. 过表达p-p53(S392)可明显下调CD133+ LCSCs的水平
![S%FJKG1]]7CM6F@C_UKL09B.jpg S%FJKG1]]7CM6F@C_UKL09B.jpg](/Sites/Uploaded/Image/2017/10/186364392243654041417373564.jpg)
图2. 促进线粒体自噬增加了p-p53(S392)与线粒体的结合,从而导致p-p53(S392)被线粒体自噬降解增加
该研究的另一项重要发现是:激酶PINK1是磷酸化p53 S392位点的关键激酶。p53 S392位点磷酸化是激活p53、促进其发挥生物学作用和减少自身降解的关键,但是对p53 S392位点有明确磷酸化作用的激酶至今尚未有定论。因此该发现为后续深入研究p53的磷酸化,尤其是S392位点的磷酸化提供了重要参考。
综上所述,该研究揭示了一个新的调控LCSCs产生的分子机制,这将为肝癌分子机制的研究提供新的研究思路。
北京佑安医院 刘慧 陈德喜 刘秀红
2017/9/6





 京公网安备11010602050066号
京公网安备11010602050066号



